🚀【JACS】 颠覆性突破!纳米“拆弹部队”精准中和真菌毒素,结直肠癌免疫疗效暴增4.99倍,开启癌症治疗新篇章!
✨文章标题:A Candidalysin-Neutralizing Nanomodulator Enhances Colorectal Cancer Immunotherapy by Targeting Fungi–Macrophage Crosstalk ✉️作者:Xian-Zheng Zhang* 等 📚期刊:Journal of the American Chemical Society 🔗链接:https://pubs.acs.org/doi/10.1021/jacs.5c13804
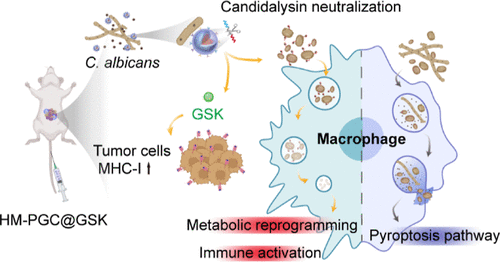
🚨 从“隐形推手”到“精准清除”:被忽略的癌症推手——真菌
在肿瘤治疗,尤其是结直肠癌(CRC)的免疫治疗领域,我们总将目光聚焦于癌细胞本身、免疫细胞和细菌。然而,一项来自《Journal of the American Chemical Society》的重磅研究提醒我们,有一个“隐形推手”一直在幕后默默地阻碍着免疫疗效,那就是真菌,特别是白色念珠菌(C. albicans) 。
最新的研究证据显示,在结直肠癌组织中,白色念珠菌的丰度显著上升 。这可不是什么好事,它的增多不仅与肿瘤的加速进展有关,还会加剧肿瘤微环境(TME)的免疫抑制状态 。简单来说,肿瘤越大、免疫越差,它就越“嚣张” 。这种真菌富集与患者生存率下降、免疫治疗应答不良呈高度负相关 。
但真菌究竟是如何帮着肿瘤作恶的呢?科研人员发现,白色念珠菌就像一个 “特洛伊木马”。它会分泌一种名为念珠菌溶素(candidalysin) 的关键毒性因子 。这种毒素进入战场后,会直接攻击TME中最丰富、最关键的免疫细胞——巨噬细胞 。
通过激活NLRP3炎症小体介导的焦亡通路,念珠菌溶素让巨噬细胞陷入“自爆” 。巨噬细胞大量死亡(总量减少了53.39% ),剩下的也会被“驯化”成促肿瘤的M2型巨噬细胞,导致M1/M2比例暴跌,从而建立起高度免疫抑制的肿瘤微环境 。这就是为什么很多免疫疗法效果不佳的核心痛点之一:免疫细胞在战斗前就被真菌毒素“团灭”了 。
这项研究的重大意义,就在于首次揭示了念珠菌溶素诱导巨噬细胞焦亡是结直肠癌免疫抑制的关键机制 ,并创造性地提出了一种纳米“拆弹部队”,来精准地拆除这个免疫抑制的“炸弹”。
💡 核心方法与技术细节解密:纳米“拆弹部队”是如何炼成的?
这项突破的核心在于一个精密设计的纳米调控剂——HM-PGC@GSK 。它不是一个传统的抗真菌药,而是一个集精准制导、毒素中和、真菌形态调控、免疫激活于一体的多功能智能纳米系统。
纳米调控剂的“三大核心组件”
HM-PGC@GSK由三个关键部分构成,它们各司其职,共同完成了对真菌-巨噬细胞轴的复杂调控:
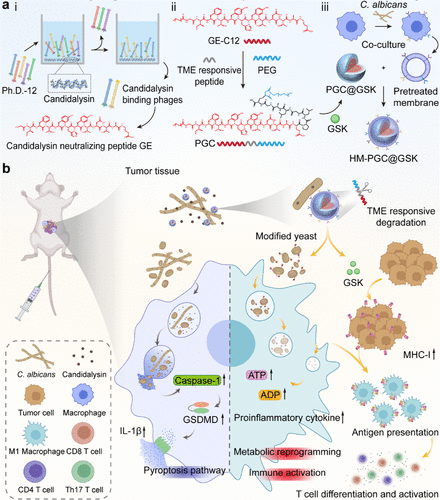
1. “毒素中和剂”:C12-GE肽链
科研人员首先通过噬菌体展示技术,从一个12肽库中筛选出了一个能特异性结合念珠菌溶素的中和肽GE(GIFTYHYTDTAE)。通过ELISA实验,他们确认了GE肽对念珠菌溶素具有更强的结合亲和力 。
随后,为了增强中和剂的效力并赋予其真菌形态调控功能,GE肽被“嫁接”上了一条长碳链C12,形成了最终的C12-GE 。C12链就像一个“形态转换开关”,它能插入白色念珠菌的磷脂双分子层,有效地将其致病性的“菌丝形态”(hyphae)转化为惰性的“酵母形态”(yeast) 。在所有测试的碳链中,C12链表现出最高的抑制效果,能将菌丝形成减少约89.4% 。
C12-GE的“双重作用”至关重要:中和毒素,阻止巨噬细胞焦亡;调控形态,进一步削弱真菌的致病力 。
2. “免疫基因调节器”:GSK-3484862(GSK)
纳米系统的第二部分是内部包裹的药物——GSK-3484862 。它是一种DNA甲基转移酶1(DNMT1)选择性非共价抑制剂,属于表观遗传调节剂 。
它的作用是解除肿瘤细胞的“伪装”。GSK通过诱导肿瘤细胞DNA去甲基化,显著上调肿瘤细胞表面主要组织相容性复合体I类分子(MHC I)的表达 。MHC I是肿瘤细胞向免疫细胞“展示”自身抗原的关键平台。GSK的激活,相当于让肿瘤细胞暴露了更多的“身份特征”,极大地促进了抗原呈递,从而增强了适应性抗肿瘤免疫,并有助于建立长期的免疫记忆 。
3. “生物制导外壳”:HM巨噬细胞膜
要将这个复杂的纳米“弹头”精准投送到肿瘤和真菌所在的位置,需要一个智能的导航系统 。科研人员创造性地使用了被白色念珠菌菌丝刺激过的巨噬细胞膜(HM) 作为纳米颗粒的外壳 。
不同形态的白色念珠菌(菌丝 vs. 酵母)会诱导巨噬细胞表面表达不同的模式识别受体(PRRs) 。研究发现,菌丝形态会特异性地上调巨噬细胞表面TLR2、TLR4和甘露糖受体(MR)的表达 。而这个独特的受体组合(PRR Profile),恰好可以作为特异性识别菌丝的“生物雷达” 。
因此,用这种 “菌丝预处理”的巨噬细胞膜包裹纳米颗粒(形成HM-PGC@GSK),使得纳米颗粒能够精准地靶向TME中的白色念珠菌菌丝,显著增强了肿瘤部位的富集和保留 。
PGC聚合物本身还整合了基质金属蛋白酶-2(MMP-2)响应肽 。由于MMP-2在肿瘤微环境中高表达,这种设计确保了纳米系统只在肿瘤部位特异性降解,释放C12-GE和GSK,从而避免了对正常肠道菌群的干扰,实现了肿瘤特异性释放和最小化脱靶效应 。
🔬 数据背后的创新与颠覆性分析:免疫疗效为何能暴增4.99倍?
这项研究的颠覆性不仅在于精巧的设计,更在于其在体外和体内模型中取得的惊人数据,有力地证明了 “干预真菌-巨噬细胞轴” 的巨大潜力。
1. 成功“拯救”巨噬细胞,逆转免疫抑制
HM-PGC@GSK的核心突破在于阻止了巨噬细胞的“自杀式”焦亡 。
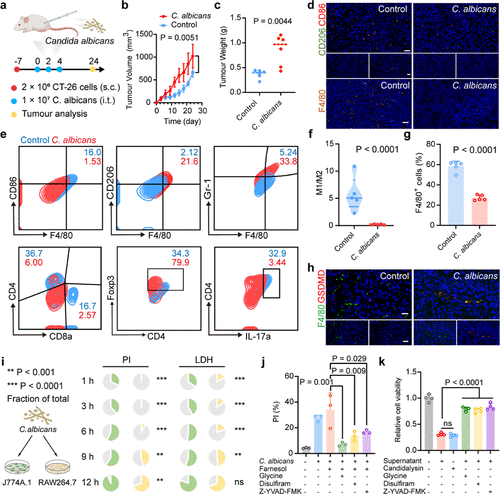
在体外实验中,单纯暴露于白色念珠菌会显著诱导巨噬细胞焦亡,表现为PI阳性细胞比例升高、LDH和炎症因子IL-1β大量释放 。而使用HM-PGC@GSK处理后,PI阳性细胞显著减少,与仅用C. albicans处理组相比,HM-PGC@GSK组的IL-1β分泌被显著抑制 。这直接证明了纳米系统成功中和了念珠菌溶素的毒性 。
更重要的是,HM-PGC@GSK不仅止损,还实现了免疫重编程 。它将巨噬细胞的表型从免疫抑制的M2样状态,逆转为促炎症的M1样抗肿瘤状态 。
M1/M2比例: HM-PGC@GSK处理后,M1/M2巨噬细胞比例显著提高,比C. albicans单独处理组提高了3.6倍 。
细胞因子分泌: 相比C. albicans处理导致的TGF-β(免疫抑制因子)升高和TNF-α(促炎症因子)降低,HM-PGC@GSK显著抑制了TGF-β分泌并促进了TNF-α表达 。
这表明,纳米系统成功将巨噬细胞从“肿瘤帮凶”变回了“抗癌主力军” 。
2. T细胞活化和IL-17反应暴增
巨噬细胞的活化迅速向下游T细胞传递了积极信号。在脾细胞共培养实验中,HM-PGC@GSK展现出对T细胞亚群的显著调控能力 。
Th17细胞: 重要的抗肿瘤免疫细胞——Th17细胞(CD4IL-17a)的比例显著增加,比C. albicans单独处理组增加了4.99倍 。
Treg细胞: 免疫抑制性的调节性T细胞(Tregs)比例则显著降低,降至C. albicans单独处理组的0.16倍 。
杀伤活性: HM-PGC@GSK处理显著增强了T细胞介导的对CT26肿瘤细胞的细胞毒性,杀伤能力比C. albicans单独处理组提高了57.83% 。
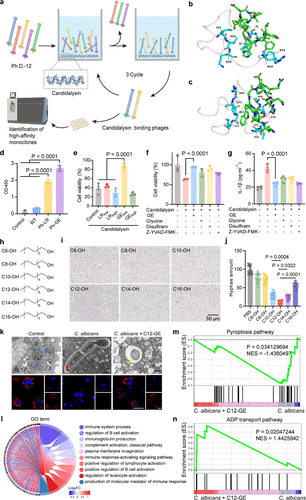
体外实验的这些数据,尤其Th17细胞比例4.99倍的增加,为体内的抗肿瘤效果奠定了坚实的免疫学基础 。
3. 体内实体瘤抑制率高达85.04%
将目光投向活体动物实验,在荷瘤小鼠皮下结直肠癌模型中,HM-PGC@GSK展现了卓越的治疗效果 。
肿瘤抑制率: 实验结果显示,HM-PGC@GSK组的肿瘤抑制率达到了惊人的85.04% ,显著高于PC对照组(25.00%)、PGC组(49.69%)和未包膜的PGC@GSK组(63.37%) 。这清晰地证明了巨噬细胞膜(HM)的靶向作用和GSK的协同效应对疗效的关键贡献 。
巨噬细胞积累: 免疫荧光分析显示,HM-PGC@GSK显著增强了巨噬细胞在肿瘤内的积累,积累量比对照组高出16.28倍 。这直接反驳了C. albicans导致的巨噬细胞流失,证明了纳米系统成功地维持了巨噬细胞在肿瘤内的存在 。
免疫细胞浸润: 在HM-PGC@GSK组中,M1样巨噬细胞增加了2.22倍,CD8杀伤性T细胞增加了3.93倍,Th17细胞增加了3.51倍,而Treg细胞比例下降了41.39% 。
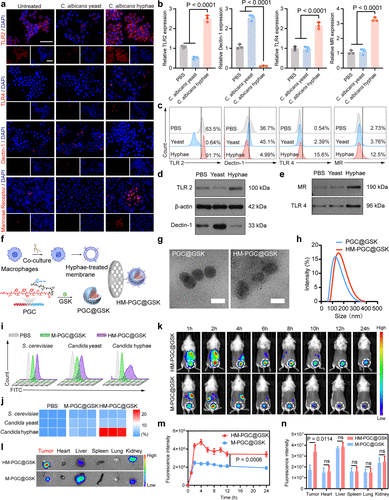
4. 联合免疫检查点阻断(ICB)疗法,肿瘤抑制率达94.35%
在更具临床挑战性的原位(Orthotopic) 结直肠癌模型中,HM-PGC@GSK与免疫检查点阻断剂αPD-1的联用效果更是达到了高潮 。
联合疗效: 联合治疗组的肿瘤抑制率达到了94.35% ,显著高于αPD-1单药组(54.28%)和HM-PGC@GSK单药组(78.67%) 。
生存期延长: 联合疗法将小鼠的中位生存期从28天延长至49天,提高了75% 。
长效免疫记忆: 在脾脏中,联合治疗显著增加了中心记忆T细胞(T) 和效应记忆T细胞(T) 的数量,分别比对照组增加了6.46倍和2.37倍 。
这些数据无可辩驳地证明,通过靶向真菌-巨噬细胞轴来解决免疫抑制的源头问题,可以极大地 “复活” 肿瘤微环境,从而显著增强现有免疫疗法的疗效,并建立起持久的抗肿瘤免疫记忆 。
🌍 应用展望、局限性与未来路线图:从实验室到临床的距离
这项研究为癌症免疫治疗,特别是那些伴有真菌感染或真菌生态失衡(fungal dysbiosis) 的肿瘤(如结直肠癌、胃肠道肿瘤),提供了一条全新的、精准的干预策略 。
HM-PGC@GSK的成功,标志着纳米医学从单纯的药物递送,迈向了 “生物环境编辑”的新阶段 。通过调节真菌的形态和毒性,修复巨噬细胞的功能,再通过表观遗传学手段激活适应性免疫,它实现了对肿瘤微环境的多维度、高精度重塑。未来,这种设计思路有望推广到其他由微生物生态失衡驱动的癌症类型 。
存在的局限性与挑战
然而,科学的严谨性要求我们正视其局限性 。
首先,尽管HM-PGC@GSK在C. albicans过量生长的模型中展现了卓越的疗效,但在缺乏C. albicans感染的原位结直肠癌模型中,它的疗效明显低于αPD-1单药,抑制率仅为30.1% 。这明确表明,该纳米调控剂的疗效是“环境依赖型”的,其首要作用是精确靶向瘤内真菌 。在临床转化中,患者的真菌丰度诊断将成为用药的前提 。
其次,研究也提及,不同巨噬细胞亚型对念珠菌溶素的敏感性可能存在差异,这与它们的代谢程序和炎症小体的基础激活状态有关 。如何在更复杂的TME中,精细调控所有巨噬细胞亚群,仍是未来的挑战 。
未来的发展路线图
展望未来,这项研究的路线图清晰而振奋人心:
个性化诊断与治疗: 进一步开发快速、精准的瘤内真菌丰度和形态诊断技术,实现 “先诊断,再纳米干预” 的个性化癌症治疗流程 。
多真菌靶向: 扩展纳米系统的靶向范围,以应对其他在不同癌症中富集的真菌种类(如肺癌中的芽生菌属、乳腺癌中的马拉色菌属)。
组合策略优化: 探索HM-PGC@GSK与更多新型免疫疗法(如CAR-T、T细胞双特异性抗体)的组合潜力,以期实现更深层次的免疫激活 。
总而言之,这项研究不仅提出了一个精巧高效的纳米解决方案,更重要的是,它为我们揭示了一个全新的免疫治疗靶点——肿瘤相关的真菌-免疫细胞轴 。纳米“拆弹部队”HM-PGC@GSK的成功,让我们有理由相信,癌症免疫治疗的未来,将更加精准、智能和有效。